Peptider er en klasse af forbindelser dannet ved forbindelsen af flere aminosyrer gennem peptidbindinger. De er allestedsnærværende i levende organismer. Indtil nu er der fundet titusinder af peptider i levende organismer. Peptider spiller en vigtig rolle i reguleringen af funktionelle aktiviteter i forskellige systemer, organer, væv og celler og i livsaktiviteter og bruges ofte i funktionel analyse, antistofforskning, lægemiddeludvikling og andre felter. Med udviklingen af bioteknologi og peptidsyntese -teknologi er der udviklet flere og flere peptidmedicin.
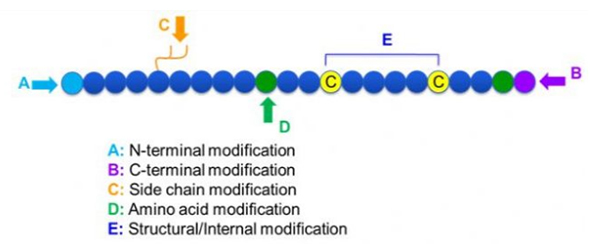
Der er en lang række peptidmodifikationer, som simpelthen kan opdeles i postmodifikation og procesmodifikation (ved hjælp af afledt aminosyremodifikation) og N-terminal modifikation, C-terminal modifikation, sidekædemodifikation, aminosyremodifikation, skeletmodifikation osv., Afhængig af modifikationsstedet (figur 1). Som et vigtigt middel til at ændre hovedkædestrukturen eller sidekædegrupperne af peptidkæder, kan peptidmodifikation effektivt ændre de fysiske og kemiske egenskaber ved peptidforbindelser, øge vandopløseligheden, forlænge handlingstiden in vivo, ændre deres biologiske distribution, eliminere immunogenicitet, reducere giftige sidevirkninger osv. I dette papir, flere hovedpeptid -modificeringsstrategier og deres egenskaber indføres.
1. cyklisering
Cykliske peptider har mange anvendelser i biomedicin, og mange naturlige peptider med biologisk aktivitet er cykliske peptider. Da cykliske peptider har en tendens til at være mere stive end lineære peptider, er de ekstremt resistente over for fordøjelsessystemet, kan overleve i fordøjelseskanalen og udvise en stærkere affinitet for målreceptorer. Cyklisering er den mest direkte måde at syntetisere cykliske peptider, især for peptider med stort strukturelt skelet. I henhold til cykliseringstilstanden kan den opdeles i sidekædeside -kædetype, terminal -sidekædetype, terminal -terminal type (slut til sluttype).
(1) Sidechain-til-sidechain
Den mest almindelige type sidekæde til sidekæde-cyklisering er disulfidbro mellem cysteinrester. Denne cyklisering introduceres af et par cysteinrester, der deprineres og oxideres derefter for at danne disulfidbindinger. Polycyklisk syntese kan opnås ved selektiv fjernelse af sulfhydrylbeskyttelsesgrupper. Cyklisering kan udføres enten i et post-dissociation-opløsningsmiddel eller på en præ-dissociation harpiks. Cyklisering på harpikser kan være mindre effektive end opløsningsmiddelcyklisering, fordi peptiderne på harpikser ikke let danner cyklificerede konformationer. En anden type sidekæde -kæde -cyklisering er dannelsen af en amidstruktur mellem en asparaginsyre eller glutaminsyrerester og basisaminosyren, som kræver, at sidekædeleskyttelsesgruppen skal være i stand til selektivt at fjernes fra polypeptidet enten på harpiksen eller efter dissociation. Den tredje type sidekæde-kæde-cyklisering er dannelsen af diphenylethere ved tyrosin eller P-hydroxyphenylglycin. Denne type cyklisering i naturlige produkter findes kun i mikrobielle produkter, og cykliseringsprodukter har ofte potentiel medicinsk værdi. Fremstilling af disse forbindelser kræver unikke reaktionsbetingelser, så de bruges ikke ofte til syntese af konventionelle peptider.

(2) terminal-til-sidechain
Terminal-kædecyklisering involverer normalt den C-terminale med aminogruppen i lysinet eller ornithin-sidekæden eller den N-terminale med asparaginsyre eller glutaminsyresidekæde. Anden polypeptidcyklisering fremstilles ved at danne etherbindinger mellem terminal C og serin- eller threonin -sidekæder.
(3) terminal eller head-to-hale type
Kædepolypeptider kan enten cykles i et opløsningsmiddel eller fastgøres på en harpiks ved sidekæde -cyklation. Lav koncentration af peptider skal anvendes i opløsningsmiddelcentralisering for at undgå oligomerisering af peptider. Udbyttet af et syntetisk ringpolypeptid med head-to-hale afhænger af sekvensen af kædepolypeptidet. Derfor, inden der forbereder cykliske peptider i stor skala, skal der først oprettes et bibliotek med mulige kædet blypeptider, efterfulgt af cyklisering for at finde sekvensen med de bedste resultater.
2. N-methylering
N-methylering forekommer oprindeligt i naturlige peptider og indføres i peptidsyntese for at forhindre dannelse af brintbindinger og derved gøre peptider mere resistente over for biologisk nedbrydning og clearance. Syntese af peptider ved anvendelse af N-methylerede aminosyrederivater er den vigtigste metode. Derudover kan Mitsunobu-reaktion af N- (2-nitrobenzensulfonylchlorid) polypeptid-resin-mellemprodukter med methanol også anvendes. Denne metode er blevet anvendt til at fremstille cykliske peptidbiblioteker indeholdende N-methylerede aminosyrer.
3. phosphorylering
Phosphorylering er en af de mest almindelige post-translationelle modifikationer i naturen. I humane celler er mere end 30% af proteinerne phosphoryleret. Phosphorylering, især reversibel phosphorylering, spiller en vigtig rolle i at kontrollere mange cellulære processer, såsom signaltransduktion, genekspression, cellecyklus og cytoskeletregulering og apoptose.
Phosphorylering kan observeres ved en række aminosyrerester, men de mest almindelige phosphoryleringsmål er serin-, threonin- og tyrosinrester. Phosphotyrosin, phosphothreonin og phosphoserinderivater kan enten indføres i peptider under syntese eller dannes efter peptidsyntese. Selektiv phosphorylering kan opnås ved hjælp af rester af serin, threonin og tyrosin, der selektivt fjerner beskyttende grupper. Nogle phosphoryleringsreagenser kan også indføre fosforsyregrupper i polypeptidet ved postmodifikation. I de senere år er stedspecifik phosphorylering af lysin opnået under anvendelse af en kemisk selektiv staudinger-phosphitreaktion (figur 3).

4. Myristoylering og Palmitoylation
Acylering af den N-terminale med fedtsyrer gør det muligt for peptider eller proteiner at binde til cellemembraner. Den myridamoylerede sekvens på de N-terminale gør det muligt at målrette SRC-familieproteinkinaser og omvendt transkriptase GAQ-proteiner til at binde til cellemembraner. Myristic acid blev knyttet til den N-terminale af harpikspolypeptidet under anvendelse af standardkoblingsreaktioner, og det resulterende lipopeptid kunne dissocieres under standardbetingelser og oprenses ved RP-HPLC.
5. Glycosylering
Glycopeptider, såsom vancomycin og teicolanin, er vigtige antibiotika til behandling af lægemiddelresistente bakterieinfektioner, og andre glycopeptider bruges ofte til at stimulere immunsystemet. Eftersom mange mikrobielle antigener er glycosyleret, er det desuden af stor betydning at studere glycopeptider til forbedring af den terapeutiske virkning af infektion. På den anden side har det vist sig, at proteinerne på cellemembranen af tumorceller udviser unormal glycosylering, hvilket får glycopeptider til at spille en vigtig rolle i kræft og tumorimmunforsvarsundersøgelse. Glycopeptider fremstilles ved FMOC/T-BU-metode. Glycosylerede rester, såsom threonin og serin, introduceres ofte i polypeptider af pentafluorophenolester aktiverede FMOC'er for at beskytte glycosylerede aminosyrer.
6. Isoprene
Isopentadienylering forekommer på cysteinrester i sidekæden nær C-terminalen. Proteinisopren kan forbedre cellemembranaffinitet og danne protein-proteininteraktion. Isopentadienerede proteiner inkluderer tyrosinphosphatase, lille GTase, cochaperonmolekyler, nuklear lamina og centromere bindingsproteiner. Isoprenpolypeptider kan fremstilles ved hjælp af isopren på harpikser eller ved at indføre cysteindivater.
7. Modifikation af polyethylenglycol (PEG)
PEG -modifikation kan bruges til at forbedre proteinhydrolytisk stabilitet, biodistribution og peptidopløselighed. Indførelsen af PEG -kæder til peptider kan forbedre deres farmakologiske egenskaber og også hæmme hydrolyse af peptider ved proteolytiske enzymer. PEG -peptider passerer lettere gennem det glomerulære kapillære tværsnit end almindelige peptider, hvilket i høj grad reducerer nyreklarering. På grund af den udvidede aktive halveringstid for PEG-peptider in vivo kan det normale behandlingsniveau opretholdes med lavere doser og mindre hyppige peptidmedicin. Imidlertid har PEG -modifikation også negative effekter. Store mængder PEG forhindrer enzymet i at nedbryde peptidet og reducerer også peptidets binding til målreceptoren. Men PEG-peptidernes lave affinitet opvejes normalt af deres længere farmakokinetiske halveringstid, og ved at være til stede i kroppen længere har PEG-peptider en større sandsynlighed for at blive absorberet i målvæv. Derfor bør PEG -polymerspecifikationer optimeres for optimale resultater. På den anden side akkumuleres PEG -peptider i leveren på grund af reduceret renal clearance, hvilket resulterer i makromolekylært syndrom. Derfor skal PEG -modifikationer være designet mere omhyggeligt, når peptider bruges til lægemiddelafprøvning.

Almindelige modifikationsgrupper af PEG-modifikatorer kan omtrent sammenfattes som følger: amino (-amin) -NH2, aminomethyl-CH2-NH2, hydroxy-oh, carboxy-cooh, sulfhydryl (-thiol) -Sh, maleimid -mal, succinimid-carbonat-SC, Succinimid acetate-acetat-SC, SUCKINIDIMIDE. -SPA, n-hydroxysuccinimide -NHS, Acrylate-ch2ch2cooh, aldehyde -CHO (such as propional-ald, butyrALD), acrylic base (-acrylate-acrl), azido-azide, biotinyl -Biotin, Fluorescein, glutaryl -GA, Acrylate Hydrazide, Alkyne-alkyne, p-toluenesulfonat -ots, succinimid succinat -SS osv. PEG-derivater med carboxylsyrer kan kobles til N-terminale aminer eller lysinsidekæder. Amino-aktiveret PEG kan kobles til asparaginsyre eller glutaminsyresidekæder. Mal-aktiveret PEG kan konjugeres til Mercaptan af fuldt afbeskyttede cysteinkidekæder [11]. PEG-modifikatorer klassificeres ofte som følger (BEMÆRK: MPEG er Methoxy-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Straight Chain Peg -modifikator
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(2) bifunktionel PEG -modifikator
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) Forgrening af PEG -modifikator
(MPEG) 2-NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Biotinisering
Biotin kan være stærkt bundet med avidin eller streptavidin, og bindingsstyrken er endda tæt på kovalent binding. Biotin-mærket peptider anvendes ofte i immunoassay, histocytokemi og fluorescensbaseret flowcytometri. Mærkede antibiotin -antistoffer kan også bruges til at binde biotinylerede peptider. Biotinetiketter er ofte fastgjort til lysin -sidekæden eller N -terminalen. 6-aminocaproic acid bruges ofte som en binding mellem peptider og biotin. Bindingen er fleksibel i binding til underlaget og binder bedre i nærvær af sterisk hindring.
9. Fluorescerende mærkning
Fluorescerende mærkning kan bruges til at spore polypeptider i levende celler og til at studere enzymer og virkningsmekanismer. Tryptophan (TRP) er fluorescerende, så det kan bruges til iboende mærkning. Emissionsspektret af tryptophan afhænger af det perifere miljø og falder med faldende opløsningsmiddelpolaritet, en egenskab, der er nyttig til detektering af peptidstruktur og receptorbinding. Tryptophan -fluorescens kan slukkes ved protoneret asparaginsyre og glutaminsyre, hvilket kan begrænse dens anvendelse. Dansylchloridgruppen (Dansyl) er meget fluorescerende, når den er bundet til en aminogruppe og ofte bruges som et fluorescerende etiket til aminosyrer eller proteiner.
Fluorescensresonans energikonvertering (FRET) er nyttig til enzymundersøgelser. Når FRET påføres, indeholder substratpolypeptidet normalt en fluorescensmærkningsgruppe og en fluorescens-slukkende gruppe. Mærkede fluorescerende grupper slukkes af slukken gennem ikke-foton energioverførsel. Når peptidet er dissocieret fra det pågældende enzym, udsender mærkningsgruppen fluorescens.
10. Cage polypeptider
Burpeptider har optisk aftagelige beskyttelsesgrupper, der beskytter peptidet mod binding til receptoren. Når peptidet udsættes for UV -stråling, aktiveres peptidet og gendanner dets tilknytning til receptoren. Da denne optiske aktivering kan kontrolleres i henhold til tid, amplitude eller placering, kan burpeptider bruges til at studere reaktioner, der forekommer i celler. De mest almindeligt anvendte beskyttelsesgrupper til cage-polypeptider er 2-nitrobenzylgrupper og deres derivater, som kan introduceres i peptidsyntese via beskyttende aminosyrederivater. Aminosyrederivater, der er udviklet, er lysin, cystein, serin og tyrosin. Aspartat- og glutamatderivater anvendes imidlertid ikke almindeligt på grund af deres modtagelighed for cyklisering under peptidsyntese og dissociation.
11. Polyantigenisk peptid (MAP)
Korte peptider er normalt ikke immun og skal kobles til bærerproteiner for at producere antistoffer. Polyantigen peptid (MAP) er sammensat af flere identiske peptider, der er forbundet til lysinkerner, som specifikt kan udtrykke immunogener med høj styrke og kan bruges til at fremstille peptid-carrier-protein-koblinger. Kortpolypeptider kan syntetiseres ved fastfasesyntese på kortharpiks. Imidlertid resulterer ufuldstændig kobling i manglende eller trunkerede peptidkæder på nogle grene og udviser således ikke egenskaberne ved det originale MAP -polypeptid. Som et alternativ kan peptider fremstilles og renses separat og derefter kobles til kort. Peptidsekvensen fastgjort til peptidkernen er veldefineret og let kendetegnet ved massespektrometri.
Konklusion
Peptidmodifikation er et vigtigt middel til at designe peptider. Kemisk modificerede peptider kan ikke kun opretholde høj biologisk aktivitet, men også effektivt undgå ulemperne ved immunogenicitet og toksicitet. På samme tid kan kemisk modifikation give peptider nogle nye fremragende egenskaber. I de senere år er metoden til C-H-aktivering til post-modificering af polypeptider hurtigt udviklet, og der er opnået mange vigtige resultater.
Posttid: 2025-07-03
