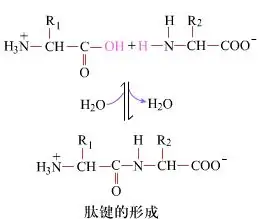
På overfladen er dannelsen af peptidbindinger, der giver dipeptider, en simpel kemisk proces.Det betyder, at de to aminosyrekomponenter er forbundet med en peptidbinding, en amidbinding, mens de er dehydrerede.
Peptidbindingsdannelse er aktiveringen af en aminosyre under milde reaktionsbetingelser.(A) carboxyldel, anden aminosyre (B) Den nukleofile aktiverede carboxyldel danner derefter dipeptidet (AB)."Hvis carboxylkomponenten (A) ikke er beskyttet, kan dannelsen af peptidbindingen ikke kontrolleres."Biprodukter såsom lineære og cykliske peptider kan blandes med målforbindelser AB.Derfor skal alle funktionelle grupper, der ikke er involveret i peptidbindingsdannelse, beskyttes på en midlertidig reversibel måde under peptidsyntese.
Så peptidsyntese - dannelsen af hver peptidbinding - involverer tre trin af aggregering.
Det første skridt er at forberede nogle aminosyrer, der har brug for beskyttelse, og den zwitterioniske struktur af aminosyrer eksisterer ikke længere.
Det andet trin er en to-trins reaktion til dannelse af peptidbindinger, hvor carboxylgruppen i den N-beskyttede aminosyre først aktiveres til det aktive mellemprodukt og derefter dannes peptidbindingen.Denne koblede reaktion kan forekomme enten som en et-trins reaktion eller som to sekventielle reaktioner.
Det tredje trin er selektiv fjernelse eller fuldstændig fjernelse af den beskyttende base.Selvom al fjernelse kun kan finde sted, efter at alle peptidkæder er blevet samlet, er selektiv fjernelse af beskyttelsesgrupper også påkrævet for at fortsætte peptidsyntesen.
Fordi 10 aminosyrer (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec og Cys) indeholder sidekædefunktionelle grupper, som kræver selektiv beskyttelse, hvilket gør peptidsyntesen mere kompliceret.Midlertidige og semi-permanente beskyttelsesbaser skal skelnes på grund af de forskellige krav til selektivitet.Midlertidige beskyttelsesgrupper bruges i det næste trin for at afspejle den midlertidige beskyttelse af aminosyre- eller carboxylfunktionelle grupper.Semi-permanente beskyttelsesgrupper fjernes uden at forstyrre allerede dannede peptidbindinger eller aminosyresidekæder, nogle gange under syntese.
"Ideelt set bør aktivering af carboxylkomponenten og efterfølgende dannelse af peptidbindinger (koblingsreaktioner) være hurtig, uden racemisk eller biproduktdannelse, og molære reaktanter bør anvendes for at opnå høje udbytter."Desværre opfylder ingen af de kemiske koblingsmetoder disse krav, og få er egnede til praktisk syntese.
Under peptidsyntese er de funktionelle grupper involveret i forskellige reaktioner sædvanligvis knyttet til det manuelle center, glycin er den eneste undtagelse, og der er en potentiel risiko for rotation.
Det sidste trin i peptidsyntesecyklussen er fjernelse af alle beskyttende grupper.Selektiv fjernelse af beskyttelsesgrupper er vigtig for peptidkædeforlængelse ud over kravet om fuldstændig fjernelse af beskyttelse i dipeptidsyntese.Syntetiske strategier bør planlægges nøje.Afhængigt af det strategiske valg kan N selektivt fjerne a-amino- eller carboxylbeskyttelsesgrupperne.Udtrykket "strategi" refererer til sekvensen af kondensationsreaktioner af individuelle aminosyrer.Generelt er der forskel på gradvis syntese og fragmentkondensering.Peptidsyntese (også kendt som "konventionel syntese") finder sted i opløsning.I de fleste tilfælde kan gradvis forlængelse af peptidkæden kun syntetiseres ved at bruge peptidkæden til at syntetisere kortere fragmenter.For at syntetisere længere peptider skal målmolekylerne segmenteres i passende fragmenter og bestemmes, at de kan minimere graden af differentiering ved C-terminalen.Efter at de individuelle fragmenter er gradvist samlet, vil målforbindelsen blive sammenføjet.Strategien for peptidsyntese omfatter udvælgelsen af det bedste og mest passende beskyttende fragment, og strategien for peptidsyntese omfatter udvælgelsen af den mest passende kombination af beskyttende baser og den bedste metode til fragmentkonjugering.
Indlægstid: 19-jul-2023